Новое исследование показывает, что биомедицинский инструмент может успешно доставлять генетический материал для редактирования дефектных генов в развивающихся клетках мозга плода. Технология, протестированная на мышах, может иметь потенциал для остановки прогрессирования генетически обусловленных нейроразвивающих расстройств, таких как синдром Ангельмана и синдром Ретта, до рождения.
Значение этого инструмента для лечения нарушений нейроразвития огромно. Мы потенциально можем исправлять генетические аномалии на базовом уровне в критические периоды развития мозга.
Айцзюнь Ван, главный автор исследования и профессор хирургии и биомедицинской инженерии Калифорнийского университета в Дэвисе
Совместное исследование Wang Lab и Murthy Lab в Калифорнийском университете в Беркли опубликовано в ACS Nano. Команда надеется развить эту технологию в методы лечения генетических заболеваний, которые можно диагностировать во время пренатального тестирования. Лечение можно проводить в утробе, чтобы избежать большего повреждения по мере развития и созревания клеток.
Внутриутробная доставка Cas9 mRNA/gRNA с ADP-LNP приводит к широкомасштабному редактированию клеток в мозге плода. Источник: UC Davis
Белки играют решающую роль в функционировании наших тел. Они собираются в клетках на основе «инструкций» от информационной РНК (мРНК). При определённых состояниях гены экспрессируют (производят) больше или меньше белков, чем нужно организму. В таких случаях организму потребуется «отключить» сверхактивный ген или восполнить низкий уровень белка.
«Белки имеют большие и сложные структуры, что затрудняет их доставку. Их доставка остаётся огромной проблемой и мечтой для лечения болезней», — сказал Ван.
Вместо доставки белков учёные нашли способ доставки мРНК в клетки, которые будут транслироваться в функциональные белки внутри клеток. Этот метод доставки использует уникальную формулу липидных наночастиц (ЛНП) для переноса мРНК. Цель состоит в том, чтобы ввести (трансфицировать) генетический материал мРНК в клетки. Затем мРНК будет транслировать инструкции для построения белков.
Доставка мРНК с использованием LNP уже трансформирует методы лечения заболеваний. Она применяется в разработке вакцин, редактировании генов и заместительной терапии белками. В последнее время доставка мРНК стала более популярной благодаря использованию в вакцинах COVID-19 от Pfizer и Moderna.
В своей работе Ван, Мурти и их команда описали новую формулу LNP для безопасной и эффективной доставки мРНК. LNP, несущие мРНК, должны «прибыть» в клетки, где будут «приняты» посредством процесса, известного как эндоцитоз. Там клетка разрушает носитель LNP, что позволяет высвободить «доставку» мРНК. Размер одной мРНК составляет около 100 нанометров. Для сравнения, толщина листа бумаги составляет около 100 000 нанометров.
«Разработанные в этом исследовании LNP используют новый кислотно-разлагаемый линкер, который позволяет LNP быстро разрушаться внутри клеток. Новый линкер также позволяет проектировать LNP с меньшей токсичностью», — сказал Нирен Мурти, профессор биоинженерии в Калифорнийском университете в Беркли и исследователь проекта.
«Когда клетки поглощают LNP, частицы разрушаются в кислой среде эндосомы клетки. Это приводит к более эффективному и раннему высвобождению мРНК в цитозоль, жидкий компонент внутри клетки, где мРНК будет транслироваться в белки. Именно там мы хотим, чтобы мРНК была эффективной и функциональной», — объяснил Ван.
Эффективность тесно связана с токсичностью. По этой причине важно знать количество носителей LNP, которое клетка должна поглотить, чтобы произвести достаточное количество белков. Если эффективность поглощения низкая, то придётся использовать много наночастиц. Это означает многократные дозы или высокие дозы, которые могут вызвать токсический иммунный ответ.
«До сих пор самым большим препятствием для доставки мРНК в центральную нервную систему была токсичность, которая приводила к воспалению», — сказал Ван.
Исследование показало, что метод LNP более эффективен при трансляции мРНК, что снижает необходимость в потенциально токсичных дозах. В работе описывается использование технологии LNP для доставки мРНК Cas9 для лечения генетических заболеваний центральной нервной системы в утробе матери. Исследователи протестировали свой инструмент на гене, ответственном за синдром Ангельмана, редком состоянии нейроразвития.
При генетическом заболевании повреждения накапливаются во время беременности и вскоре после рождения. Исследования показывают, что более эффективно доставлять терапию к клеткам мозга до того, как гематоэнцефалический барьер у младенцев полностью сформируется. Поэтому чем раньше происходит коррекция, тем лучше. Идея заключалась в том, чтобы остановить прогрессирование заболевания in utero [внутриутробно].
Исследователи ввели LNP с мРНК в желудочки мозга плода мышей. мРНК транслируется в CAS9, белок, который работает как ножницы для редактирования генов. Полученный CAS9 будет редактировать ген, ответственный за синдром Ангельмана.
«МРНК похожа на инструкцию Lego, в которой есть инструкции по сборке деталей для формирования функциональных белков. У самой клетки есть все детали для построения CAS9. Нам просто нужно предоставить последовательность мРНК, а клетка возьмёт и переведет её в белки», — объяснил Ван.
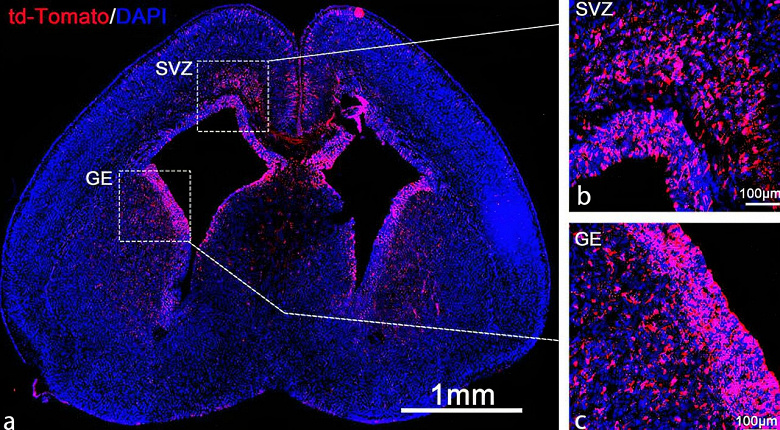
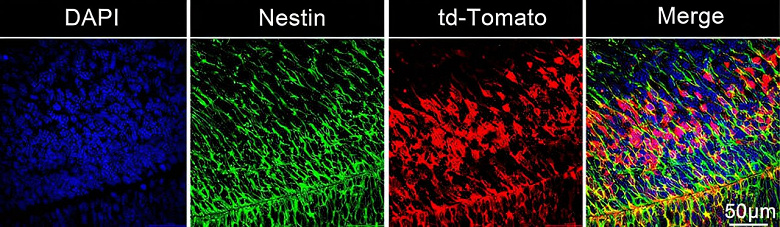
Исследование показало, что инструмент LNP оказался весьма эффективным в доставке мРНК, транслируемой в CAS 9. Используя трассеры, исследователи смогли увидеть все нейроны, которые были отредактированы внутри мозга. Их исследование показало, что наночастицы были поглощены развивающимися нейронными стволовыми и прогениторными клетками мозга. Наночастицы привели к редактированию генов в 30% стволовых клеток мозга мышей.
«Трансфекция 30% всего мозга, особенно стволовых клеток, — это большое дело. Эти клетки мигрируют и распространяются во многие области мозга по мере дальнейшего развития плода», — сказал Ван.
Окрашивание стволовых и прогениторных клеток в мозге плода, трансфицированных Cre мРНК, доставленной LNP. Источник: UC Davis
В ходе исследования, по мере того как развивался плод, стволовые клетки размножались и мигрировали, формируя центральную нервную систему. Исследование показало, что более 60% нейронов в гиппокампе и 40% нейронов в коре были трансфицированы.
«Это очень многообещающий метод лечения генетических заболеваний, влияющих на центральную нервную систему. Когда дети рождаются, многие нейроны могут быть [уже] исправлены. Это означает, что ребенок может родиться без каких-либо симптомов», — пояснил Ван.
Ван ожидает увидеть ещё более высокий процент трансфицированных клеток больной мыши.
«Нейроны с мутацией могут погибнуть из-за накопления симптомов заболевания, а "хорошие" нейроны могут остаться и размножиться. Это может привести к усилению терапевтической эффективности. Если мы достаточно хорошо знаем, как работают клетки, то мы можем использовать эти знания для взаимодействия с естественными путями в клетке», — сказал он.
Исследователи надеются, что их работа приведёт к разработке новых методов лечения генетических заболеваний, которые можно диагностировать во время пренатального тестирования. Они также надеются, что их технология может быть использована для лечения других заболеваний, таких как рак и неврологические расстройства.
Учёные планируют продолжить свою работу, чтобы улучшить эффективность и безопасность технологии. Они также планируют провести клинические испытания, чтобы проверить эффективность такого метода лечения на людях.